金属的活动性是反映金属在水溶液里形成水合离子倾向的大小,也就是反映金属在水溶液里起氧化反应的难易,它是以金属的标准电极电位为依据的。从能量角度来看,金属的标准电极电位除了与金属元素原子的电离能有关外,同时还与金属的升华能、水合能等多种因素有关。金属的活动性顺序最初是由化学家根据金属间的置换反应,还有金属跟水和各种酸、碱的反应总结而成。常见金属活动顺序由强到弱分别是:钾 、钙 、钠 、镁 、铝、 锌、 铁、 锡、 铅、 氢、铜 、汞 、银、 铂、 金。
金属活动性的判定依据是金属的标准电极电势,而金属性的判定依据只与金属失电子能力有关。
金属性:指在化学反应中金属元素失去电子的能力。失电子能力越强的粒子其元素金属性就越强,反之越弱。金属性常表示元素的原子失去电子的倾向,元素的非金属性是指元素的原子得电子的能力。
金属活动性:指金属单质在水溶液中失去电子生成金属阳离子的倾向,属于热力学范畴。利用金属活动性,可以比较金属在水中的还原性强弱与其对应的阳离子的氧化性强弱,预测水中一系列的置换反应的方向。
金属性是失去电子的能力没错金属活动性是由元素的核外电子排布决定的,也就是元素本身的性质,金属活动性越强实际上也就是金属性越强。金属活动性最强是锂,金属活动性是个热力学标准,由标态下的电极电势决定。
声明: 我们致力于保护作者版权,注重分享,被刊用文章因无法核实真实出处,未能及时与作者取得联系,或有版权异议的,请联系管理员,我们会立即处理,本站部分文字与图片资源来自于网络,转载是出于传递更多信息之目的,若有来源标注错误或侵犯了您的合法权益,请立即通知我们(管理员邮箱:daokedao3713@qq.com),情况属实,我们会第一时间予以删除,并同时向您表示歉意,谢谢!

 999+
999+ 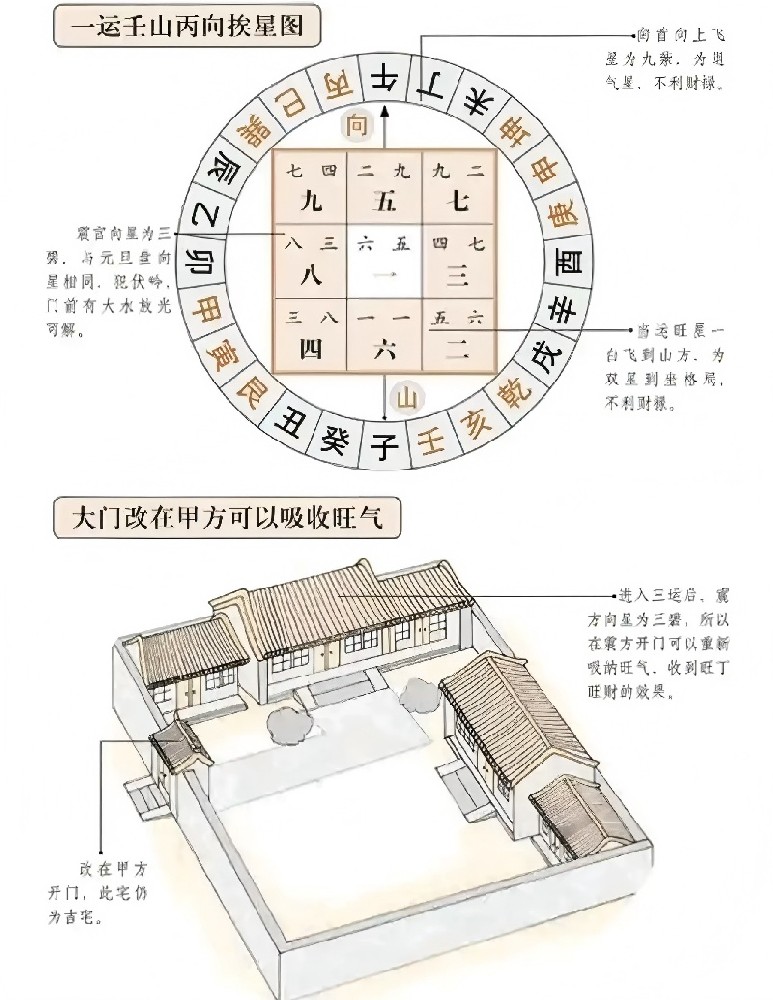
 13
13 
 1843
1843 
 1922
1922 
 1576
1576 
 1961
1961 
 1481
1481 
 833
833 
 689
689 
 1540
1540 本站内容仅供参考,不作为诊断及医疗依据,如有医疗需求,请务必前往正规医院就诊
祝由网所有文章及资料均为作者提供或网友推荐收集整理而来,仅供爱好者学习和研究使用,版权归原作者所有。
如本站内容有侵犯您的合法权益,请和我们取得联系,我们将立即改正或删除。
Copyright © 2022-2023 祝由师网 版权所有
邮箱:daokedao3713@qq.com